Triterpeny
Triterpeny stejně jako mono-, seskvi-, di-, sester- a tetra- tvoří rozsáhlou podskupinu přírodních látek – terpenoidů, které jsou široce rozšířeny nejen ve vyšších rostlinách, ale v ojedinělých případech i v mořských organizmech, plísních, mikroorganizmech anebo vzácněji též houbách.1,2 Terpenoidy společně se steroidy pak vyplňují velmi rozsáhlou oblast isoprenoidů. Jak z názvu vyplývá, základním stavebním kamenem všech isoprenoidů je isopren (2-methylbut-1,3-dien). Biosyntéza triterpenů pak vychází ze skvalenu. Monoterpeny (dvě stavební jednotky) – např. kafr, borneol, menthol, pinen, limonen, karvon, citronelol, jasmon, terpinen, terpineol, geraniol a částečně též seskviterpeny (3 staveb. jednotky) - např. jonony, methyljonony, iron, nerolidol, farnesol, cedrol, karyofylen ztělesňují zástupce přírodních vůní,3 protože tvoří majoritní část silic a pryskyřic, kdežto sester-, tetra- a triterpeny jsou většinou tuhé látky vyskytující se v přírodě nejčastěji volné nebo vázané ve formě esterů nebo glykosidů.
Dosud bylo z přírodních zdrojů izolováno více než 30 000 terpenoidů, což zahrnuje 4 000 triterpenoidů odvozených od více než 40 skeletálních typů1,2,4. Paleta biologických aktivit triterpenů4 je neuvěřitelně široká a zahrnuje např. antimikrobiální (fusidová a helvolová kys.), antifídantní (radermasinin), antimykotické (trianthenol), protivirové (der. kyseliny betulinové), protizánětlivé (deriváty boswellové kys., platycodin D, betulin, lupeol) protinádorové účinky (betulinová, boswellová, pomolová kys.), dále antikariogenní (oleanolová, glycyrrhetová kyselina), antiangiogenní, antiulcerózní (glycyrrhetová, ursolová a oleanolová kyselina), protialergické (oleanolová kyselina), hepatoprotektivní (lupeol, ursolová, oleanolová k.), tonizující aktivity (24-hydroxytormentiková a boswell. kys.) a mnohé další.
Ačkoli některé z dříve zmiňovaných biologických aktivit triterpenoidů jsou známy již dlouhou dobu, z jejich využití převážně v orientální neboli lidové medicíně5 (např. kůra brazilského stromu Ocotea suaveolens, je v tradiční medicíně dlouhá léta používána pro úlevu bolesti, dále jako tonikum a pro léčbu astmatu)6, takže jejich farmaceutický potenciál je zatím využit jen z velmi malé části.
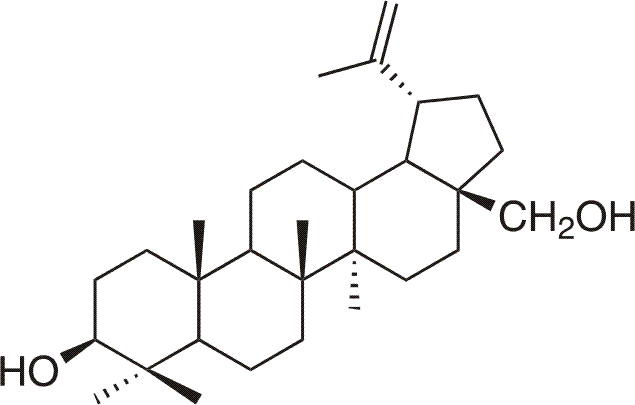 Betulin je přírodní pentacyklický triterpenický alkohol (lup-20(29)-en-3β,28-diol), který je hojně zastoupen v přírodě, zejména pak v kůře bříz (Betula sp.)7, odkud pochází také jeho název. Betulin byl jedním z prvních triterpenoidů, který se podařilo získat Löwitzovi roku 1788 sublimací z březové kůry jako čistou chemickou substanci.7Následně byl získáván extrakcí svrchních vrstev březové kůry ethanolem. Trvalo však několik desetiletí, než byla jeho struktura přesně určena. V podstatě bílá barva březové kůry je způsobena právě přítomným betulinem, který tak uděluje březové kůře specifické vlastnosti. Např. březová kůra nikdy neshnije ani neplesniví, což je způsobeno právě protiplísňovými a antibakteriálními vlastnostmi betulinu. Velkou neznámou je, proč vlastně břízy syntetizují betulin a ukládají jej do kůry. Pravděpodobně se jedná o přirozený prostředek proti požeru a napadení mikroorganismy. Betulin a jeho deriváty však disponují dalšími zajímavými biologickými účinky, např. protizánětlivými, protivirovými, anti-HIV, hepatoprotektivními a dalšími.4
Betulin je přírodní pentacyklický triterpenický alkohol (lup-20(29)-en-3β,28-diol), který je hojně zastoupen v přírodě, zejména pak v kůře bříz (Betula sp.)7, odkud pochází také jeho název. Betulin byl jedním z prvních triterpenoidů, který se podařilo získat Löwitzovi roku 1788 sublimací z březové kůry jako čistou chemickou substanci.7Následně byl získáván extrakcí svrchních vrstev březové kůry ethanolem. Trvalo však několik desetiletí, než byla jeho struktura přesně určena. V podstatě bílá barva březové kůry je způsobena právě přítomným betulinem, který tak uděluje březové kůře specifické vlastnosti. Např. březová kůra nikdy neshnije ani neplesniví, což je způsobeno právě protiplísňovými a antibakteriálními vlastnostmi betulinu. Velkou neznámou je, proč vlastně břízy syntetizují betulin a ukládají jej do kůry. Pravděpodobně se jedná o přirozený prostředek proti požeru a napadení mikroorganismy. Betulin a jeho deriváty však disponují dalšími zajímavými biologickými účinky, např. protizánětlivými, protivirovými, anti-HIV, hepatoprotektivními a dalšími.4
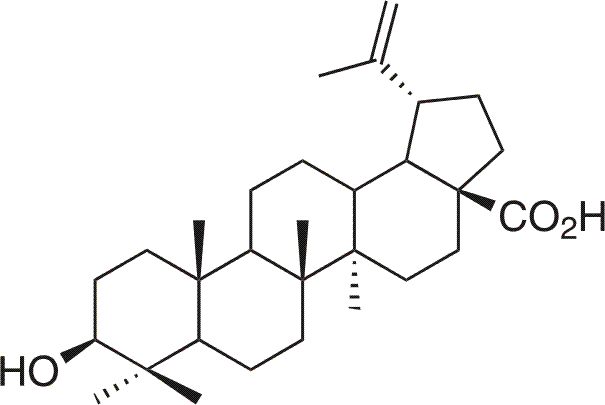 Kyselina betulinová je přírodní pentacyklická kyselina (3β-hydroxylup-20(29)-en-28-ová kyselina), která je též hojně zastoupena v přírodě.
Poprvé byla izolována roku 1976 z Vauquelinia corymbosa,8 dále také z afrického keře Ziziphus mauritiana Lam. (Rhamnaceae)9, nebo ji lze získat též z kůry platanu (Platanus hispanica)10. Kyselině betulinové se zatím dostalo daleko více pozornosti než betulinu, zejm. díky její selektivní protinádorové aktivitě vůči buňkám lidského melanomu. Některé deriváty kyseliny betulinové též vykazují výborné anti-HIV a další protivirové účinky.4
Kyselina betulinová je přírodní pentacyklická kyselina (3β-hydroxylup-20(29)-en-28-ová kyselina), která je též hojně zastoupena v přírodě.
Poprvé byla izolována roku 1976 z Vauquelinia corymbosa,8 dále také z afrického keře Ziziphus mauritiana Lam. (Rhamnaceae)9, nebo ji lze získat též z kůry platanu (Platanus hispanica)10. Kyselině betulinové se zatím dostalo daleko více pozornosti než betulinu, zejm. díky její selektivní protinádorové aktivitě vůči buňkám lidského melanomu. Některé deriváty kyseliny betulinové též vykazují výborné anti-HIV a další protivirové účinky.4
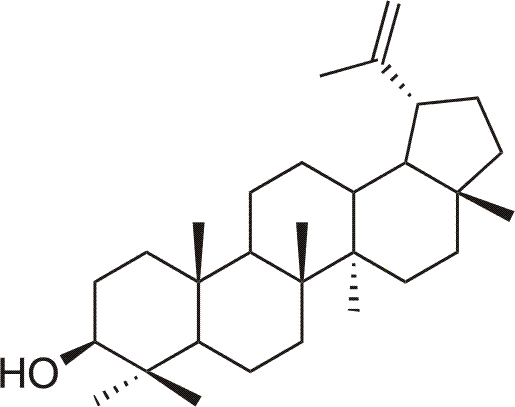 Lupeol je přírodní pentacyklický triterpenický alkohol (lup-20(29)-en-3β-ol), který se vyskytuje v řadě léčivých rostlin4 nebo ovoci (např. jablka, mango), kromě toho také v přírodě doprovází betulin. Lupeol vykazuje jisté chemopreventivní4, cytotoxické a protipožerové účinky4, také vykazuje přímé antioxidační působení a je potenciálním léčivem onemocnění vyvolaných volnými radikály4. Mezi další aktivity patří antiangiogenní účinek (od 30 µg/ml)4.
Lupeol je přírodní pentacyklický triterpenický alkohol (lup-20(29)-en-3β-ol), který se vyskytuje v řadě léčivých rostlin4 nebo ovoci (např. jablka, mango), kromě toho také v přírodě doprovází betulin. Lupeol vykazuje jisté chemopreventivní4, cytotoxické a protipožerové účinky4, také vykazuje přímé antioxidační působení a je potenciálním léčivem onemocnění vyvolaných volnými radikály4. Mezi další aktivity patří antiangiogenní účinek (od 30 µg/ml)4.
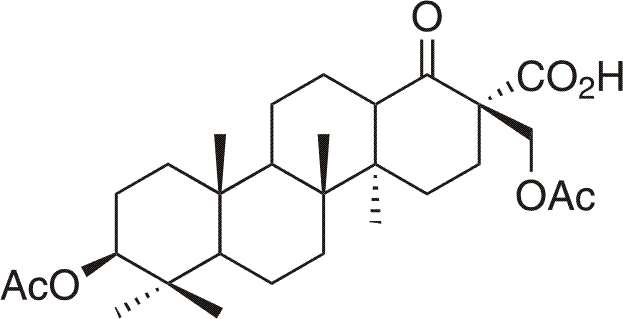
Betulininy11 reprezentují skupinu triterpenoidů připravených Janem Šarkem v letech 1999-2001 ve skupině přírodních látek, Katedry organické chemie, Přírodovědecké fakulty, Univerzity Karlovy, odvozených od lupanového, des-E-lupanového a 18α-oleananového skeletu, které disponují, kromě jiných, významnou protinádorovou aktivitou (IC50 < 5 µmol/l). Na rozdíl od nejdéle známého cytotoxického triterpenu kyseliny betulinové není protinádorová aktivita betulininů vázána pouze na buněčné linie melanomu (MeL-2). Betulininy disponují širokospektrální protinádorovou aktivitou vůči mnoha nádorovým liniím různého histogenetického původu včetně multidrug rezistentních11, např. A549, Saos2, BT549, DU145, OVCAR-3, K562, U2OS, CEM atd. Zmiňovaná širokospektrální účinnost betulininů sahá až k buňkám p53 negativním, pRb negativním, bez ohledu na jejich histogenetický původ, přičemž vykazují nižší toxicitu vůči nenádorovým buňkám.11 Z morfologické kontroly tkáňových kultur buněk s nejúčinnější sloučeninou - betaketokyselinou (3β,28-diacetoxy-19,20,21,29,30-pentanorlupan-22-ová kyselina), která vykazuje na většině testovaných nádorových liniích cytotoxicitu nižší než 1 µmol/l, vyplývá, že mechanismem účinku je apoptóza (programovaná buněčná smrt), viz následující obrázek.11

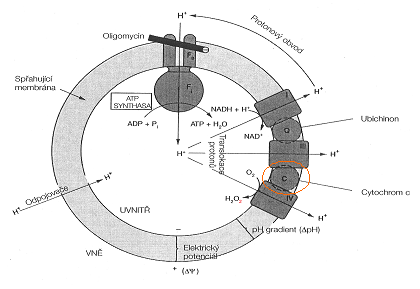
Jak bylo zjištěno metodou průtokové cytometrie, betaketokyselina způsobuje velice rychlou apoptózu, která je dokonce rychlejší než u paklitaxelu, jednoho z nejúčinnějších konvenčních cytostatik. Dle současných poznatků je mechanismus aktivace apoptózy zprostředkován nejčastěji aktivací kaskády kaspáz uvolněním cytochromu c, případně AIF (apoptózu indukující faktor). Betaketokyselina způsobuje blok v G1/S fázi buněčného cyklu. Na základě posledních experimentů vyplývá, že tato sloučenina má zcela unikátní schopnost zablokovat poslední krok respiračního řetězce a následně spustit produkci peroxidového radikálu, resp. peroxidu vodíku (viz obrázek). K zablokování pravděpodobně dochází díky přímé konjugaci betaketokyseliny s cytochromem c. Jedná se tedy o zásah do mitochondriálního respiračního řetězce, takže primární cíl betulininů je lokalizován v mitochondriích.12
Literatura:
1. J. D. Connolly and R. A. Hill: Nat. Prod. Rep. 22, 230 (2005).2. J. D. Connolly and R. A. Hill, Nat. Prod. Rep. 22, 487 (2005).
3. Vonášek F., Trepková E., Novotný L.: Látky vonné a chuťové, SNTL, Praha 1987.
4. Dzubak P., Hajduch M., Vydra D., Hustova A., Kvasnica M., Biedermann D., Markova L., Urban M., Sarek J.: Nat. Prod. Rep. 23, 394 (2006).
5. Kosuge T, Yokota M, Sugiyama K, Mure T, Yamazawa H, Yamamoto T.: Chem. Pharm. Bull. 33, 5355 (1985).
6. A.Beirith,A.R.Santos,J.B.Calixto,S.C.Hess,I.Messana,F. Ferrari and R.A.Yunes, Planta Med. 65, 50 (1999).
7. Simonsen J., Ross W. C. J.: The Terpenes IV, Cambridge Univ. Press, London 1957.
8. Trumbull E. R., Bianchi E., Eckert D. J., Wiedhopf R. M., Cole J. R.: Pharm. Sci. 65, 1407 (1976).
9. Simonsen J., Ross W. C. J.: The Terpenes. V, Cambridge Univ. Press, London 1957.
10. Urban M., Sarek J., Klinot J., Korinkova G., Hajduch M.: J. Nat. Prod. 67, 1100 (2004).
11. Sarek J., Klinot J., Dzubak P., Klinotova E., Noskova V., Krecek V., Korinkova G., Thomson J. O., Janostakova A., Wang S., Parsons S., Fischer P. M., Zhelev N. Z., Hajduch M.: J. Med. Chem. 46, 5402 (2003).
12. Dzubak P., Sarek J., Anzenbacher P., Masek V., Novak P., Havlicek V., Vydra D., and Hajduch M.: PNAS, in press, 2007.
